
科目: 来源: 题型:解答题
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目: 来源: 题型:实验题
 现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:
现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:| 序号 | 待测液体积(ml) | 所消耗标准盐酸的体积(ml) | ||
| 滴定前 | 滴定后 | 消耗体积 | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | ? | ? | ? |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |
查看答案和解析>>
科目: 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,3.01×1023个CCl4所占的体积约为11.2 L | |
| B. | 80 g NH4NO3晶体中约含有NH4+ 6.02×1023个 | |
| C. | 3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022 | |
| D. | 46 g NO2和N2O4混合气体中含有原子数约为1.806×1024 |
查看答案和解析>>
科目: 来源: 题型:实验题
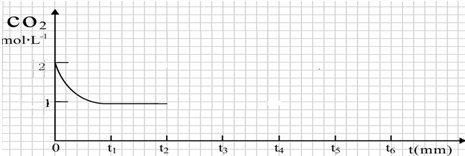
| 反应条件 | 反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com