
科目: 来源: 题型:选择题
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减小 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 醋酸的电离常数K随醋酸浓度减小而减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应 | |
| B. | 弱碱性条件下,甲酸乙酯能与氢氧化铜反应,乙酸乙酯也能与氢氧化铜反应 | |
| C. | 苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色 | |
| D. | CO2与SiO2均为酸性氧化物,CO2能与NaOH溶液反应,SiO2也能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
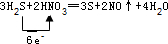 .
.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
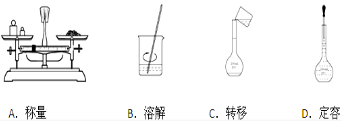
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com