
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
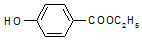 ,生产过程如图:
,生产过程如图: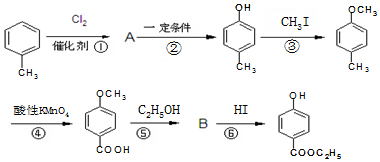
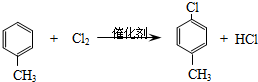 .
. ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.查看答案和解析>>
科目: 来源: 题型:实验题
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
查看答案和解析>>
科目: 来源: 题型:实验题
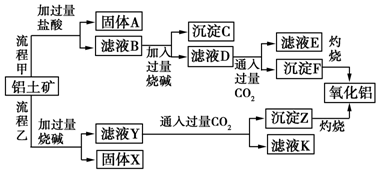
查看答案和解析>>
科目: 来源: 题型:解答题
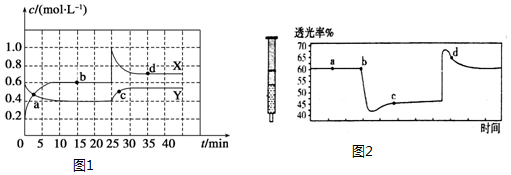
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
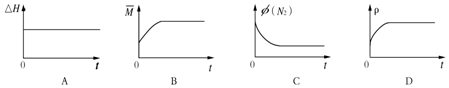
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com