
科目: 来源: 题型:选择题
| A. | 用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol•(L•min)-1 | |
| B. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol | |
| C. | 若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% | |
| D. | 维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
查看答案和解析>>
科目: 来源: 题型:实验题
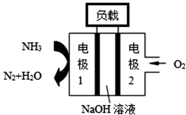 (1)已知
(1)已知查看答案和解析>>
科目: 来源: 题型:推断题
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
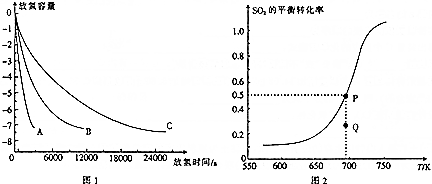
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
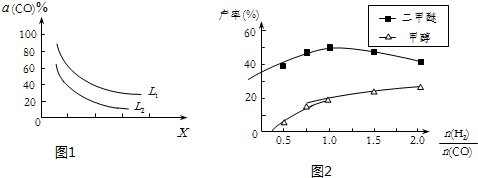
查看答案和解析>>
科目: 来源: 题型:解答题
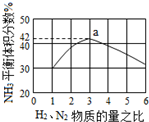 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.查看答案和解析>>
科目: 来源: 题型:解答题
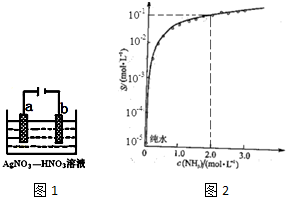
查看答案和解析>>
科目: 来源: 题型:解答题
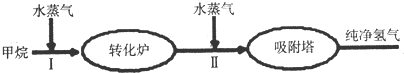
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
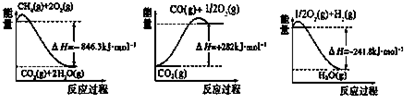
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com