
科目: 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 推广垃圾分类投放、分类回收、分类处理 | |
| B. | 氮、磷的植物的营养元素,含氮、磷化合物的生活污水直接排放 | |
| C. | 使用沼气、太阳能、风能等能源代替传统的煤炭 | |
| D. | 研制开发燃料电池汽车,减少机动车尾气污染 |
查看答案和解析>>
科目: 来源: 题型:解答题
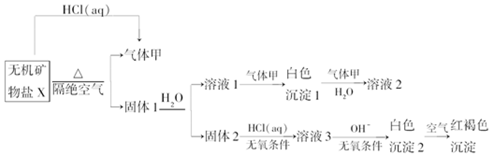
 ,写出气体甲的电子式
,写出气体甲的电子式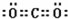 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
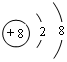 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式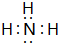 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.查看答案和解析>>
科目: 来源: 题型:选择题
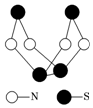 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | |
| B. | 该物质的分子中只含共价键 | |
| C. | 该物质具有很高的熔、沸点 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要由金属元素和非金属元素形成的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8个电子的稳定结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
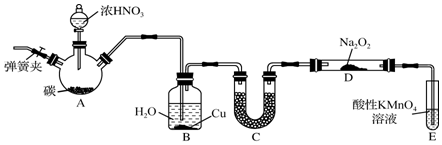
查看答案和解析>>
科目: 来源: 题型:解答题
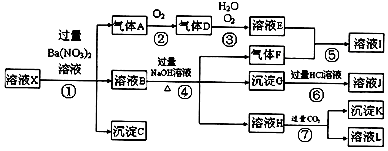
查看答案和解析>>
科目: 来源: 题型:推断题
| X | Y | |
| Z | W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com