
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

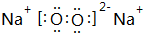 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ① | B. | ①⑤ | C. | ①②⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 硫酸锶难溶于水,但易溶于盐酸 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | X和Z元素形成的化合物广泛应用于制造集成电路、太阳能电池板等 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目: 来源: 题型:解答题
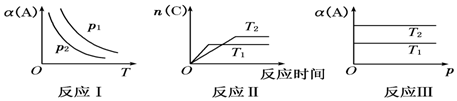
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
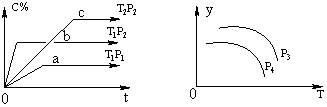
| A. | p3>p4,y轴表示A的物质的量分数 | |
| B. | 若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 | |
| C. | p3<p4,y轴表示平衡常数K | |
| D. | p3>p4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com