
科目: 来源: 题型:选择题
| A. | a=b=c | B. | b>a>c | C. | b>c>a | D. | b=c>a |
查看答案和解析>>
科目: 来源: 题型:推断题
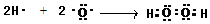 ;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.
;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钡溶液中加入少量稀硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | NaClO(aq)中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
查看答案和解析>>
科目: 来源: 题型:填空题
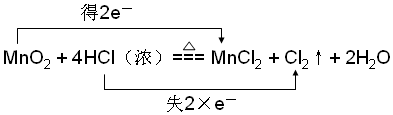 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目: 来源: 题型:实验题
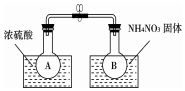 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com