
科目: 来源: 题型:选择题
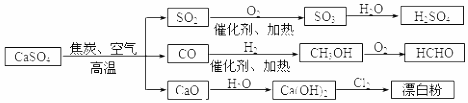
| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.9g/mol | B. | 26 | C. | 26 g/mol | D. | 29.3 g/mol |
查看答案和解析>>
科目: 来源: 题型:实验题
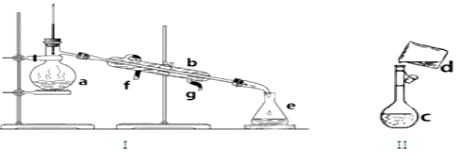
查看答案和解析>>
科目: 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
用pH试纸测定某无色溶液的pH时,规范的操作是(  )
)
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
查看答案和解析>>
科目: 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
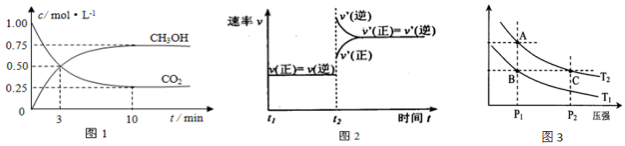
查看答案和解析>>
科目: 来源: 题型:解答题
| O═O | H-H | H-O(g) | ||
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x | |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向逆反应方向移动了 | D. | a>b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 常温下,pH=7的溶液中:Al3+、Cl-、HCO3-、SO42- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Cu2+、S2-、Cl- | |
| D. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com