
科目: 来源: 题型:选择题
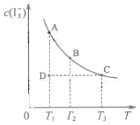 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态,忽略I2 的挥发).下列说法正确的是( )| A. | 反应 I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A与状态B相比,状态A的c(I2)大 | |
| C. | 若反应进行到状态D时,一定有v逆>v正 | |
| D. | 若温度为T1、T2,反应的平衡常数K1、K2则 K1>K2 |
查看答案和解析>>
科目: 来源: 题型:推断题
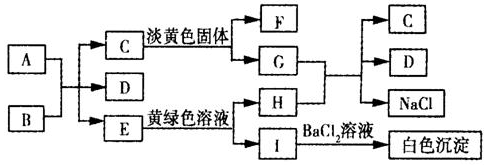
查看答案和解析>>
科目: 来源: 题型:实验题
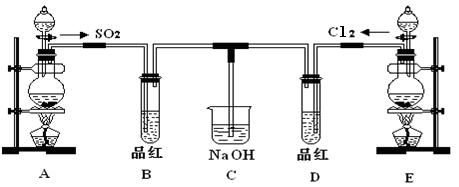
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 实验 |  | 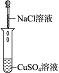 | 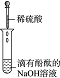 | 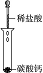 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
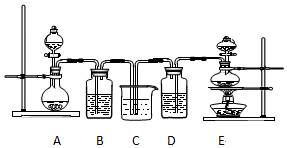

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com