
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
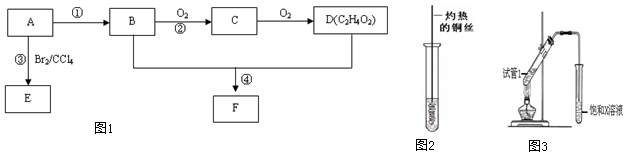
查看答案和解析>>
科目: 来源: 题型:解答题
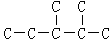 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 医用酒精的浓度为75% (体积比浓度) | |
| C. | 福尔马林是甲醛的水溶液,具有杀菌防腐能力,因此可以用其保鲜鱼肉等食品 | |
| D. | 苯酚有毒但可以制成药皂,具有杀菌消毒的功效 |
查看答案和解析>>
科目: 来源: 题型:解答题
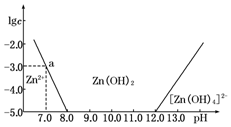
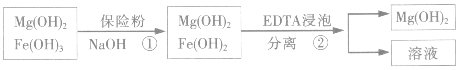
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水电离产生的c(H+):①=③>④=② | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量;②最大 | |
| D. | 向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相等 | B. | 后者是前者的11倍 | ||
| C. | 后者是前者的108 | D. | 前者是后者的108 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
查看答案和解析>>
科目: 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com