
科目: 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
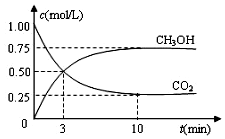 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纤维素、蛋白质、油脂都是高分子化合物 | |
| B. | 糖类、蛋白质、油脂都是由C、H、O三种元素组成的 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 只用淀粉溶液就可鉴别市售食盐是否为加碘盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(l)△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com