
科目: 来源: 题型:填空题
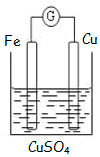 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室中酒精灯着火,立即用水扑灭 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24 L水中含有的分子数约为0.l NA | |
| B. | 在常温常压下,1 mol He含有的原子数为NA | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5mol/L FeCl3溶液中Cl-的数目为1.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,平衡常数K变大 | |
| B. | 增大压强,W(g)物质的量分数变大 | |
| C. | 升温,若混合气体的平均相对分子质量变小,则正反应放热 | |
| D. | 增大X浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应:查看答案和解析>>
科目: 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
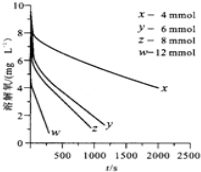
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目: 来源: 题型:解答题
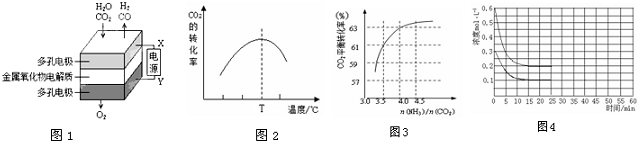
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com