
科目: 来源: 题型:解答题
 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
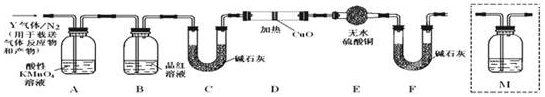
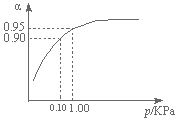
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 7.80 g Na2O2与5.85 g NaCl所含阴离子数相等 | |
| D. | 常温常压下,18g H2O含有的氢原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
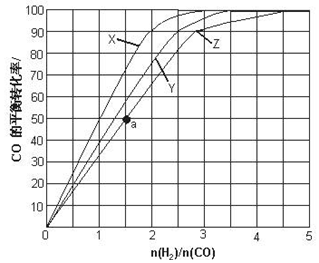
查看答案和解析>>
科目: 来源: 题型:解答题

 则该化合物的化学式为MgCNi3(用对应的元素符号表示).
则该化合物的化学式为MgCNi3(用对应的元素符号表示).查看答案和解析>>
科目: 来源: 题型:解答题
 ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目: 来源: 题型:选择题
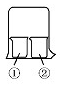 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) | ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | 淀粉KI溶液浓硝酸无明显变化 | B. | 酚酞溶液浓盐酸无明显变化 | ||
| C. | AlCl3溶液浓氨水有白色沉淀 | D. | 湿润红纸条饱和氯水红纸条褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com