
科目: 来源: 题型:解答题
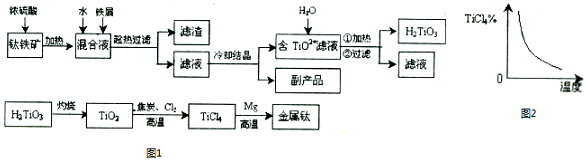
查看答案和解析>>
科目: 来源: 题型:解答题
 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.查看答案和解析>>
科目: 来源: 题型:实验题
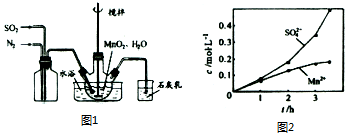
查看答案和解析>>
科目: 来源: 题型:解答题
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题
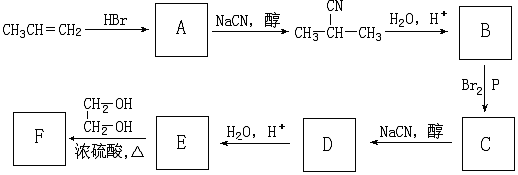
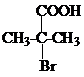 +NaCN$\stackrel{醇}{→}$NaBr+
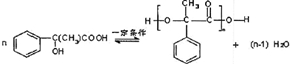
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$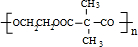 +2nH2O.
+2nH2O.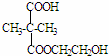 ,②分子内含有一个七元环
,②分子内含有一个七元环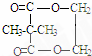 .
.查看答案和解析>>
科目: 来源: 题型:解答题
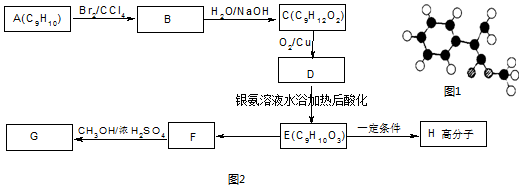
 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为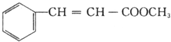 .
.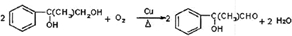
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com