
科目: 来源: 题型:实验题
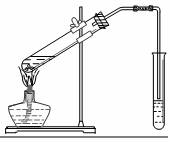 乙醇、乙酸都是有机化工重要的基础原料.
乙醇、乙酸都是有机化工重要的基础原料.| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
| 实验序号 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| a | 2 | 2 | 1.33 |
| b | 3 | 2 | 1.57 |
| c | 4 | 2 | X |
| d | 5 | 2 | 1.76 |
| e | 2 | 3 | 1.55 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价. |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍. |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态. |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧. |
 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}$U3+ | 该铀离子核外有89个电子 |
| B | 2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ. |
| C | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | NaCl氧化性比Cl2强 |
| D | FeO+4H++NO3-═Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目: 来源: 题型:解答题
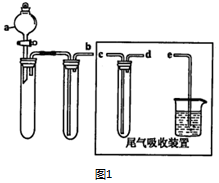
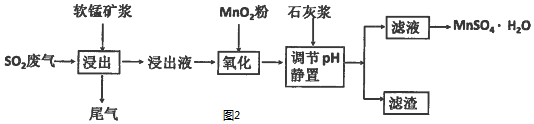
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
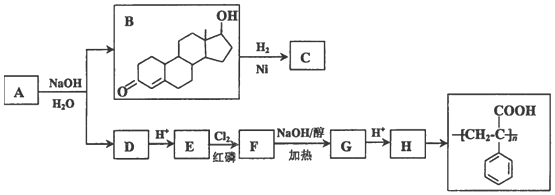
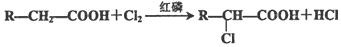
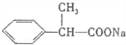 .
.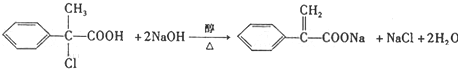 .
.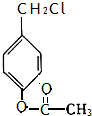 、
、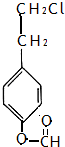 .
.查看答案和解析>>
科目: 来源: 题型:解答题
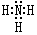 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.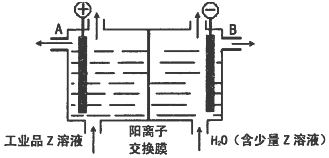
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com