
科目: 来源: 题型:解答题
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
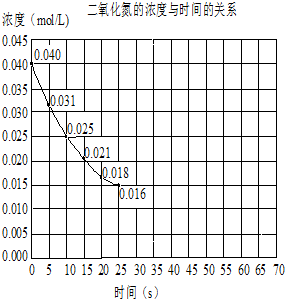
科目: 来源: 题型:解答题
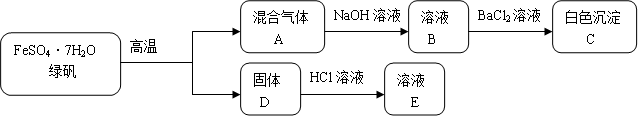
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 1mol/L的盐酸中含HCl分子的数目为NA | |
| B. | 1 mol Cl2与足量的铁反应转移的电子数是3 NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键键数目为3.5NA | |
| D. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
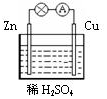
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有浓硫酸参与的反应都是氧化还原反应 | |
| B. | 硫在足量空气中燃烧生成大量SO3 | |
| C. | SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 | |
| D. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com