
科目: 来源: 题型:选择题
| A. | 上述反应均为氧化还原反应 | |
| B. | 反应①、②中氧化剂都是氧气 | |
| C. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中通常发生吸氧腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食用松花蛋时蘸些食醋可以去除氨味 | |
| B. | 用双氧水的稀溶液清洗伤口可以杀菌消毒 | |
| C. | 用淀粉溶液检验某食盐是否为加碘盐 | |
| D. | 长期使用含氟牙膏可预防龋齿 |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
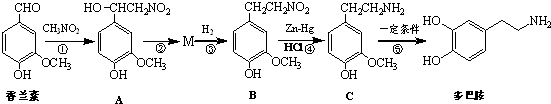
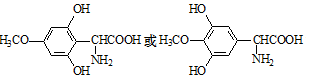 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com