
科目: 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molO2参加反应转移电子数一定为4NA | |
| B. | 一定条件下,足量铜与2 mol的浓硫酸充分反应,转移电子数为2NA | |
| C. | 300mL2mol/L乙醇溶液中所含乙醇分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
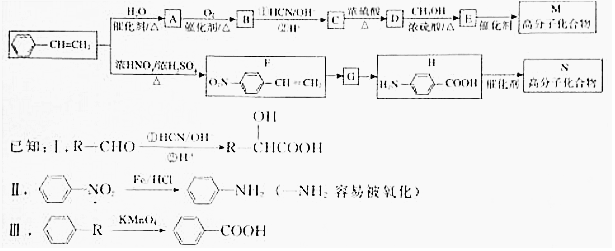
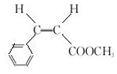 .
. 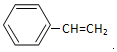 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.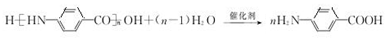 .
.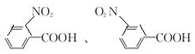 .
.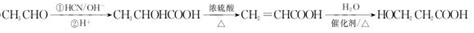 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 元素的最高化合价Z大于Y | |
| B. | 元素的气态氢化物的稳定性W强于Y | |
| C. | 原子半径Z比Y小 | |
| D. | 元素的最高价氧化物的水化物酸性X大于W |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 3O2(g)=2O3(g)△H=+242.4kJ•mol-1 | |
| B. | 氧气比臭氧稳定,大气中臭氧层易被破坏 | |
| C. | 断裂l mol O2(g)中的共价键吸收的能量比形成1 molCO2(g)中的共价键放出的能量少 | |
| D. | 相同物质的量的氧气比臭氧所含的能量高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 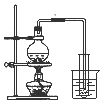 制取少量蒸馏水 | B. |  制取少量NO2 | ||
| C. | 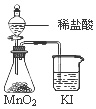 比较MnO2、Cl2、I2的氧化性 | D. |  量取8.50mL的 稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com