
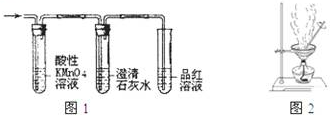
科目: 来源: 题型:选择题
| A. | CH4、O2、CO、NH3 | B. | H2、O2、SO2、NH3 | C. | H2、Cl2、HCl、NH3 | D. | NO、O2、NO2、NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目: 来源: 题型:解答题

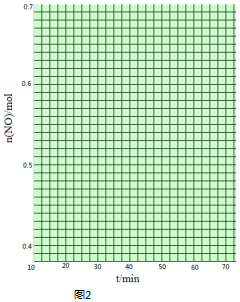
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+) |
查看答案和解析>>
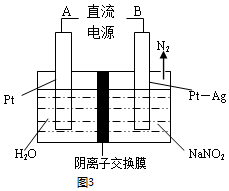
科目: 来源: 题型:选择题
| A. | 将乙醛加入含有新制银氨溶液的试管中,于沸水浴中加热来制得银镜 | |
| B. | 称量12.5gCuSO4•5H2O,配成100mL溶液,得到0.5mol/L的CuSO4溶液 | |
| C. | 用图1装置检验实验室制得的乙烯中混有SO2和CO2 | |
| D. | 利用图2装置从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA | |
| C. | 一定条件下,5.6 g铁与浓硫酸恰好反应,转移的电子数目一定为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:推断题
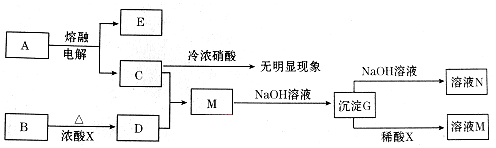
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
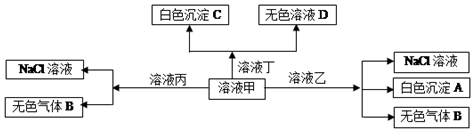
| A. | 在甲中滴加丁开始反应的离子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com