
科目: 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
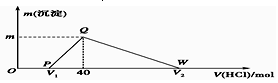
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三氧化二铁中有少量的氧化铝:加过量的烧碱溶液后过滤洗涤 | |
| B. | 氯化钠中有少量的I2:通过加热的方法 | |
| C. | CO中有少量的CO2:用氢氧化钠洗涤后再干燥 | |
| D. | 食盐中有少量的氧化铝:加过量的烧碱溶液后蒸发结晶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 澄清石灰水 | C. | 2 mol/L 盐酸 | D. | 2 mol/L 硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com