
科目: 来源: 题型:解答题
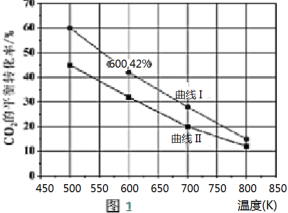 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
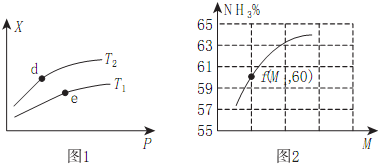 已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497
已知有关热化学方程式为:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905kJ/mol;②3H2(g)+N2(g)2NH3(g)△H=-92.4kJ/mol;③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;④N2(g)+O2(g)=2NO(g)△H=QkJ/mol;反应①中有关化学键的键能(kJ/mol)如下:H-O:463,H-N:391,O=O:497查看答案和解析>>
科目: 来源: 题型:解答题
 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.
图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
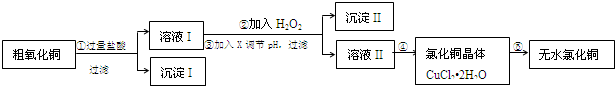
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
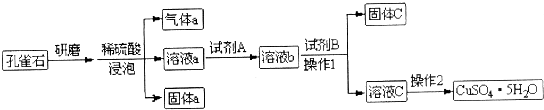
| A. | 研磨孔雀石的目的是增大固体表面积,从而加快反应速率 | |
| B. | 试剂A目的是将溶液中Fe2+转化为Fe3+,可选用双氧水作氧化剂 | |
| C. | 试剂B目的是作pH调节剂,使Fe3+转化为沉淀 | |
| D. | 试剂B可以选择NaOH或氨水等碱性试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com