
科目: 来源: 题型:选择题
| A. | CH3CHO (l) | B. | CH3CHO (g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
 ,
,查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: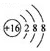 | |
| B. | 原子核内有10个质子的氧原子${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: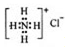 | |
| D. | 邻氯甲苯的结构简式: |
查看答案和解析>>
科目: 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熵减的吸热反应可能是自发反应 | |
| B. | 需要加热的化学反应,生成物的总能量一定高于反应物的总能量 | |
| C. | 使用催化剂既不会改变反应的限度又不会改变反应的焓变 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
查看答案和解析>>
科目: 来源: 题型:实验题
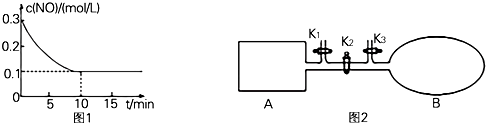
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com