
科目: 来源: 题型:选择题

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
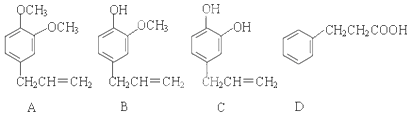

 ;
; .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 可用加热氯化铵分解的方法制取氨气 | |
| C. | 在BaCl2溶液中通入SO2气体会产生白色沉淀 | |
| D. | 向某无色溶液中加入AgNO3溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中可能含有Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子数目为0.5NA | |
| B. | 常温下,1.8g水中含有的电子数为NA | |
| C. | 0.1 mol Cl2与足量氢氧化钠溶液反应,转移的电子数为0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com