
科目: 来源: 题型:选择题
| A. | 核内质子数与中子数之差为136 | |
| B. | 氡元素位于元素周期表中第六周期Ⅷ族 | |
| C. | 氡气的分子式为Rn2 | |
| D. | 氡元素性质稳定,很难与其他元素化合 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合金的硬度一般比各组分金属的低 | B. | 合金中可能含有非金属元素 | ||
| C. | 合金中肯定含有金属元素 | D. | 合金的熔点一般比各组分金属的低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氟利昂或NO2都可破坏臭氧层而导致“温室效应” | |
| B. | 蜂蚁蜇咬人的皮肤时,会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛 | |
| C. | 向燃料煤中加入生石灰,可减少对大气的污染 | |
| D. | 热水瓶中的水垢的主要成分是CaCO3和Mg(OH)2 |
查看答案和解析>>
科目: 来源: 题型:实验题
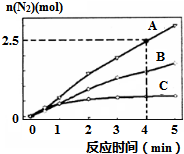 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | x | 465 | 413 |
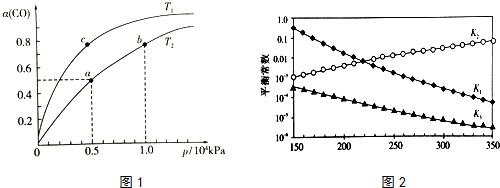
查看答案和解析>>
科目: 来源: 题型:实验题
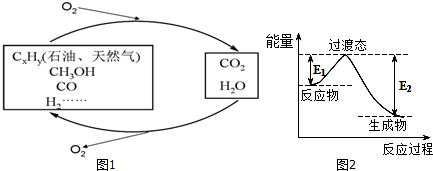
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目: 来源: 题型:解答题

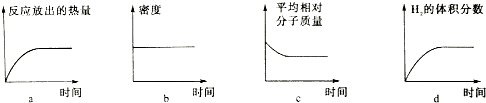
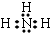 .
.
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
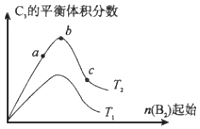
查看答案和解析>>
科目: 来源: 题型:解答题
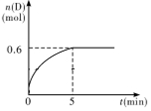
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com