
科目: 来源: 题型:选择题
| A. | 根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 | |
| B. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| C. | 根据分散剂粒子的大小,将分散系分为溶液、浊液和胶体 | |
| D. | 根据纯净物的元素组成,将纯净物分为单质和化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 31.6 g高锰酸钾完全分解产生O2的体积约为2.24 L | |
| B. | 在25℃、101KPa时,24.5L氨气所含质子数约为10NA | |
| C. | 0.3 mol•L-1硫酸钠溶液中所含Na+和SO42-总物质的量为0.9 mol | |
| D. | 25℃、101KPa下,2.24 L二氧化碳与二氧化硫的混合气体中所含氧原子数约为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铁和盐酸:O2-+2H+═H2O | |
| B. | 向澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 澄清石灰水和Ca(HCO3)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氢氧化钡溶液和硫酸镁溶液反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:计算题
| c值范围 | 被氧化的离子符号 | 被氧化离子的物质的量/mol |
| 0<c≤a | ① | ② |
| a<c≤$\frac{3a+b}{2}$ | ③ | ④ |
| $\frac{3a+b}{2}$<c≤3$\frac{a+b}{2}$ | ⑤ | ⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
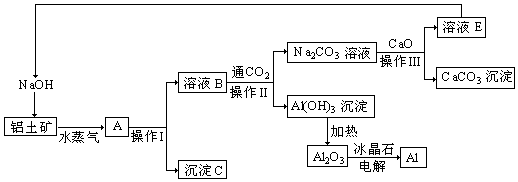
查看答案和解析>>
科目: 来源: 题型:实验题
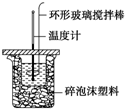 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
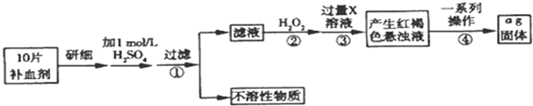
查看答案和解析>>
科目: 来源: 题型:解答题
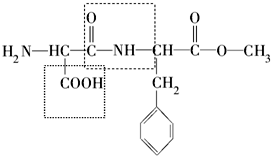 为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:
为纪念化学学科所取得的成就以及对人类文明的贡献,联合国将2011年定为“国际化学年”,其主题为“化学──我们的生活,我们的未来”.化学关注食品安全、人类健康和社会的可持续发展,为改善人类生活质量、提高人类生活水平发挥了重要作用.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com