
科目: 来源: 题型:实验题
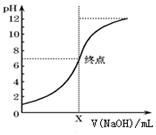 某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
某学生用0.10mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.| 数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 23.40 |
| 第二次 | 25.00 | 4.00 | 23.90 |
| 第三次 | 25.00 | 5.00 | 25.10 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以共存 | |
| B. | 水电离的c(H+)=1×10-3mol/L的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | 由0.l moI/L BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | $\frac{{K}_{W}}{(O{H}^{-})}$=1×10-13mol/L 的溶液中:Ba2+、ClO-、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
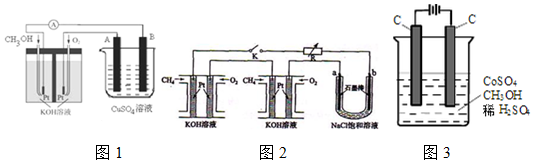
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com