
科目: 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 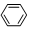 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$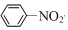 +H2O +H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
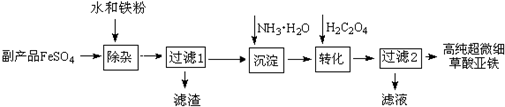
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com