
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
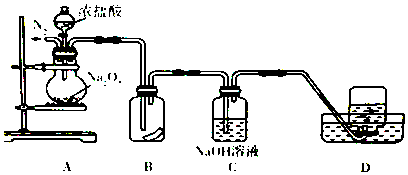
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeSO4溶液中滴加NaOH浓液 | B. | 碳酸氢钠溶液中滴加稀盐酸溶液 | ||
| C. | 硫酸铁溶液中滴加硫氰化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中加入AgNO3溶液,可生成白色沉淀,加稀盐酸沉淀不消失,则可确定该溶液中一定含有Cl-, | |
| B. | 用试管加热碳酸氢钠固体时试管口竖直向上 | |
| C. | 实验室需要800mL0.1mol•L-1NaOH溶液,需要称取4.0gNaOH进行配制 | |
| D. | 实验室中可用碱石灰干燥氯气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Cu2+、Cl-、NO3-、OH- | ||
| C. | Ca2+、Na+、CO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气可用于自来水的消毒 | |
| B. | 四氧化三铁常用作红色油漆和涂料 | |
| C. | 明矾可用于净水 | |
| D. | 过氧化钠用于呼吸面具和潜水艇里氧气的来源 |
查看答案和解析>>
科目: 来源: 题型:实验题
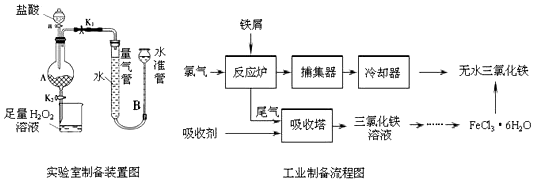
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com