
科目: 来源: 题型:解答题
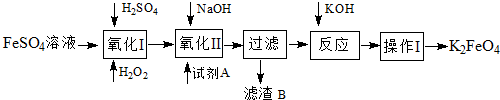
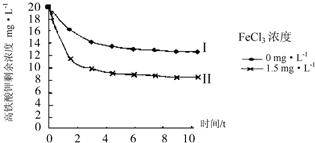
查看答案和解析>>
科目: 来源: 题型:解答题
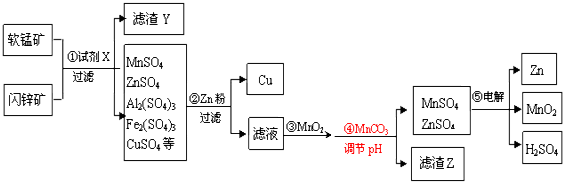
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
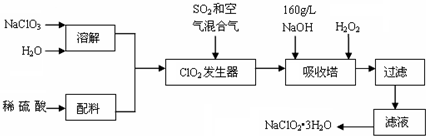
查看答案和解析>>
科目: 来源: 题型:解答题
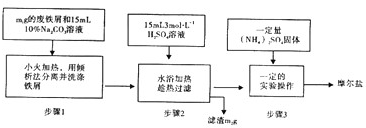
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
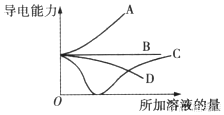
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 维生素C具有还原性,在人体内起抗氧化作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com