
科目: 来源: 题型:推断题

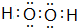 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-
,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-查看答案和解析>>
科目: 来源: 题型:解答题
 ,AC2的电子式
,AC2的电子式
查看答案和解析>>
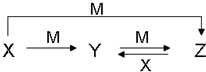
科目: 来源: 题型:解答题
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnO2 | B. | FeCl2 | C. | 稀盐酸 | D. | NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:实验题
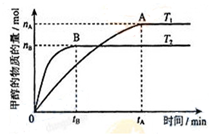 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下 .
.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
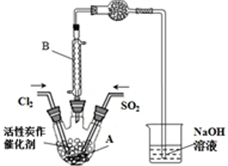 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目: 来源: 题型:实验题
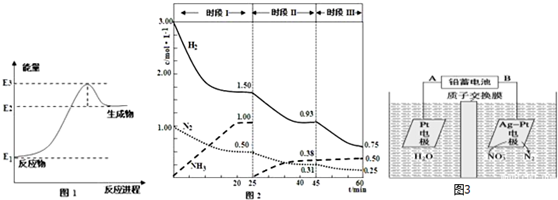
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com