
科目: 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
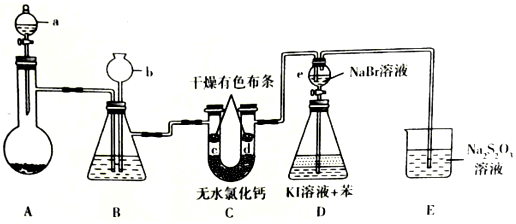
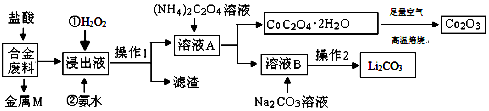
查看答案和解析>>
科目: 来源: 题型:选择题
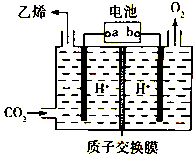 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c(N{a}^{+})}{2c(C{O}_{3}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba (OH)2溶液中:2c (NH4+)=c ( Ba2+) | |
| C. | 等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3) | |
| D. | 向Mg (OH)2浊液中加入少量NH4Cl粉末$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图2 中反应速率最快的是容器丙 | |
| B. | 图1 中容器乙的反应可能使用了催化剂 | |
| C. | 图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=0.012mol/(L•min) | |
| D. | 图1 中容器丙内反应的平衡常数为2.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
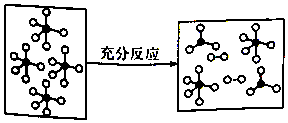 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为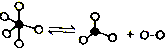 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com