
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 操作 | 现象 |
| Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
| Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
| Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
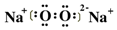 ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表
,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 | |
| C. | 步骤Ⅱ中无色气体是NO气体 | |
| D. | 原溶液中肯定含有K+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| B. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 向0.1mol•L-1的醋酸溶液中加水稀释后溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$不变 | |
| D. | 向0.1mol•L-1的醋酸溶液稀释到原体积的10倍后,溶液的PH=2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将碳酸氢钠分解产生的气体通入CaCl2溶液 | 产生白色沉淀 | CO2与CaCl2溶液反应 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将水蒸气通过灼热的铁粉 | 有黑色晶体生成 | 铁与水在高温下发生反应 |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为浅色蓝色沉淀 | Mg(OH)2的溶度积(Ksp)比Cu(OH)2小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成 | |
| B. | PH计不能用于酸碱中和滴定终点的判断 | |
| C. | 石油的分馏,煤的干馏、气化、液化均是物理变化 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目: 来源: 题型:解答题


| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com