
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

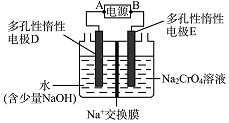
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验过程 | 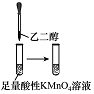 |  | 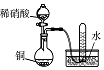 |  |
| 实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
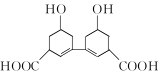
| A. | 分子式为C14H18O6 | B. | 含有羟基、羧基和苯基 | ||
| C. | 能发生取代反应 | D. | 能使溴的水溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:多选题
| X | Y | ||
| Z | W | Q |
| A. | 阴离子的还原性:W2-<Q-<Y- | |
| B. | 常温下,X2与W的单质间化合反应不能自发进行 | |
| C. | ZX2是两性氧化物 | |
| D. | Y的氢化物可用来篆刻玻璃 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,2.24 LSO2中所含氧原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 1 mol NO2与足量H2O反应,转移的电子数为NA | |
| D. | 0.1 mol熔融的NaHSO4中阳离子数目为0.lNA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以Na2O2作供氧剂时,发生了氧化还原反应 | |
| B. | 在食品袋中放人CaCl2•6H2O,可防止食物受潮 | |
| C. | 人工合成食品级酯可以用作糖果的香料 | |
| D. | 用NH4Cl浓溶液除铁锈,因为NH4 Cl水解显酸性 |
查看答案和解析>>
科目: 来源: 题型:解答题
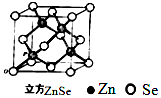 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.查看答案和解析>>
科目: 来源: 题型:解答题
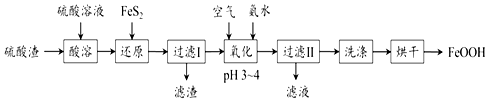
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com