
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
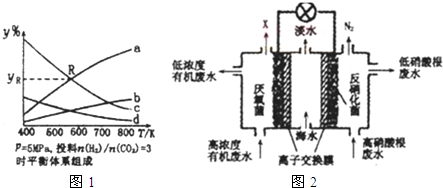
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 实验 | 预期现象和结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰①该气体为氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量此空删去②稀盐酸 | 产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2溶液 | 产生白色沉淀;溶液中存在此空删去③CO32-离子 |
查看答案和解析>>
科目: 来源: 题型:解答题
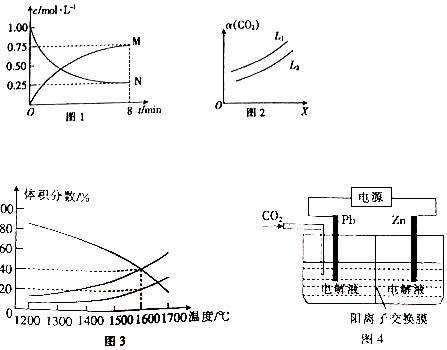
查看答案和解析>>
科目: 来源: 题型:解答题
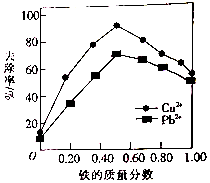 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com