
科目: 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 从蛇纹石组成看,其成皆是碱性氧化物 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铝溶液与过量氨水的反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氯水与碘化钾溶液的反应:Cl2+2I-═2Cl-+I2 | |
| C. | 铁粉与足量稀硫酸的反应:2Fe+3H+═2Fe3++3H2↑ | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使品红溶液褪色 | B. | 能使石蕊试液先变红再褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用NaOH溶液鉴别SO2和CO2两种气体 | |
| B. | 用湿润的淀粉-KI试纸检验氯化氢中是否混有氯气 | |
| C. | 用BaCl2溶液鉴别Na2SO4和Na2CO3两种溶液 | |
| D. | 用FeCl2溶液检验新制氯水中含有HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾在水中形成的AI(OH)3胶体能吸收水中悬浮物,可用于水的净化 | |
| B. | Sio2是良好的半导体材料,常用于制造计算机的芯片 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | 浓硫酸在常温下可用铁制容器保存 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
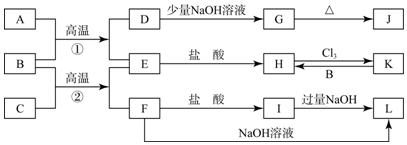
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com