
科目: 来源: 题型:选择题
| A. | Cl2水置于棕色试剂瓶避光保存 | |
| B. | 盛NaOH溶液的试剂瓶用磨口玻璃塞 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴加KSCN溶液 | B. | 先加硝酸根,再加硝酸酸化 | ||
| C. | 利用焰色反应 | D. | 先加盐酸酸化,再加氯化钡 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,48gO3含有的氧原子数为NA | |
| B. | 11.2LSO3中含有的SO3分子数为NA | |
| C. | 1.8g的NH4+离子中含有的电子数为NA | |
| D. | 0.1L2mol/LNaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 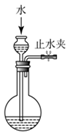 检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 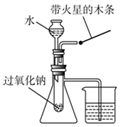 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
查看答案和解析>>
科目: 来源: 题型:计算题
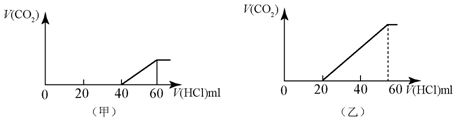
查看答案和解析>>
科目: 来源: 题型:推断题
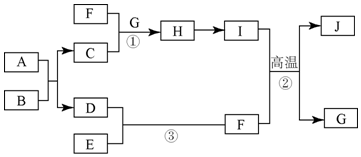
查看答案和解析>>
科目: 来源: 题型:实验题
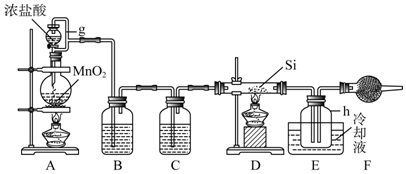
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
查看答案和解析>>
科目: 来源: 题型:实验题
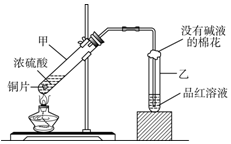 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com