
科目: 来源: 题型:选择题
| A. | Ba2+、Na+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、SO42- | ||
| C. | NH4+、K+、Cl-、OH- | D. | K+、H+、SO32-、ClO- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
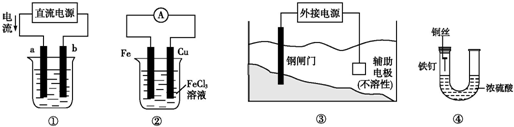
| A. | 用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Fe+2Fe3+═3Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的负极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
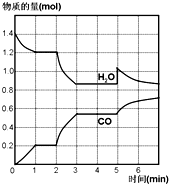 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com