
科目: 来源: 题型:选择题
| A. | 用物质A表示的平均反应速率为0.3mol/(L•s) | |
| B. | 用物质B表示的平均反应速率为0.6mol/(L•s) | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质B的浓度为0.5mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 操作及现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
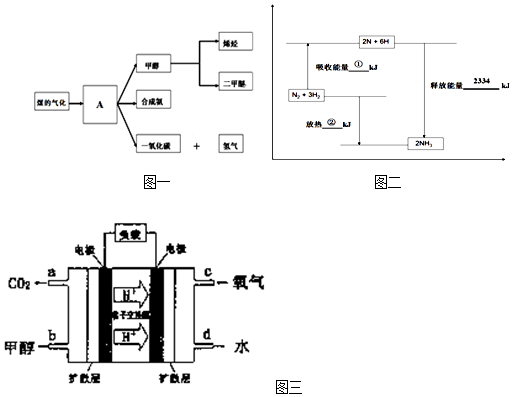
查看答案和解析>>
科目: 来源: 题型:解答题
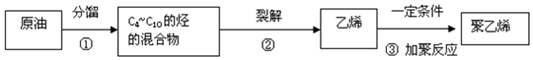
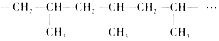 其重复结构单元即它的链节是
其重复结构单元即它的链节是 .
.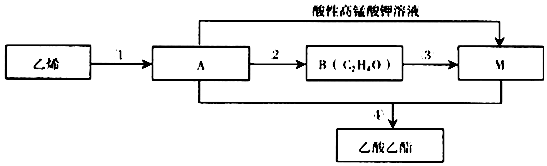
 ,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
,由A生成B的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.
CH3COOCH2CH3+H2O,除去乙酸乙酯中混有A和M的方法通入饱和碳酸钠溶液吸收.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 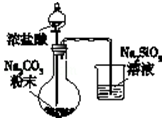 验证酸性:H2CO3>H2SiO3 | |
| B. | 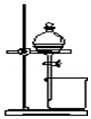 用于分离CCl4萃取碘水后的有机层和水层 | |
| C. | 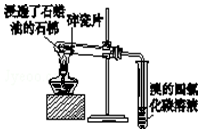 证明石蜡油分解生成的气体是乙烯 | |
| D. | 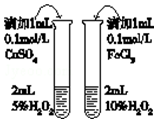 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只须验证它完全燃烧后产物只有H2O和CO2 | |
| B. | 只须测定其燃烧产物中H2O 和CO2 物质的量的比值 | |
| C. | 测定完全燃烧时消耗有机物与生成的H2O、CO2 的物质的量之比 | |
| D. | 测定该试样的质量及试样完全燃烧后生成H2O 和CO2 的质量 |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com