
科目: 来源: 题型:选择题
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
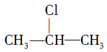 +NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,
+NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,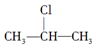 $→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系:
$→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系: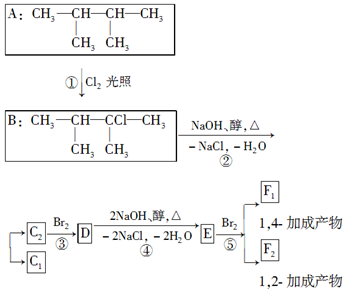
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的NH4Cl溶液与NaOH溶液混合,c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目: 来源: 题型:选择题
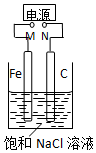
| A. | M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 | |
| B. | M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 | |
| C. | M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1molNaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- | |
| B. | 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 | |
| C. | 先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- | |
| D. | 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:填空题
 如图原电池装置图:
如图原电池装置图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容量瓶在使用前一定要检漏、洗涤并烘干 | |
| B. | 使用胶头滴管时,特殊情况下也可把滴管插入到溶液中 | |
| C. | 萃取过程中,不需要打开分液漏斗的玻璃塞,以防止其漏气 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com