
科目: 来源: 题型:填空题
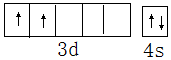
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 方法 | 结论 |
| A | 实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 | 可以加快制备氢气的反应速率 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行 | 则该反应的△S<0 |
| D | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA | |
| B. | 标准状况下,40gSO3中含有分子的数目为0.5NA | |
| C. | 标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA | |
| D. | 常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③ | B. | ①③⑥ | C. | ③⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目: 来源: 题型:推断题
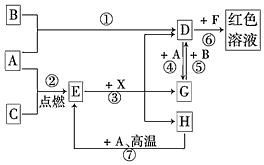 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体.D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体.它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去).查看答案和解析>>
科目: 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
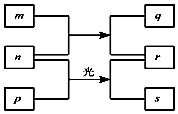 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | |
| B. | 元素的非金属性Z>X>Y | |
| C. | Y的氢化物常温常压下为气态 | |
| D. | X的最高价氧化物对应的水化物为弱酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%
(1)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将100g样品加热使其质量不再变化,其质量变为96.9%,则该样品的纯度(质量分数)是91.6%查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com