
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.63g,第二次称量读数为4.66g |
| 阴离子符号 | 物质的量浓度(mol/L) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 自然界中存在大量单质硅 | |
| B. | 石英、水晶、硅石的主要成分都是二氧化硅 | |
| C. | 常温下硅性质活泼,能与氯气、强酸反应 | |
| D. | 自然界中的硅是以二氧化硅或硅酸盐的形式存在 |
查看答案和解析>>
科目: 来源: 题型:解答题
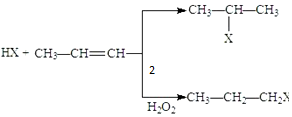 (X为卤素原子)
(X为卤素原子)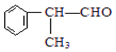 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$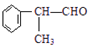
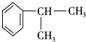 .
.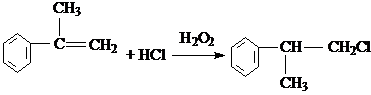 、2
、2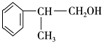 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.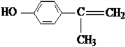 、
、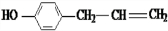 、
、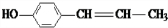 .
.查看答案和解析>>
科目: 来源: 题型:实验题
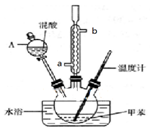 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):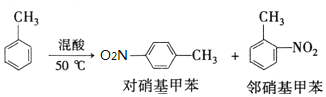
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目: 来源: 题型:推断题
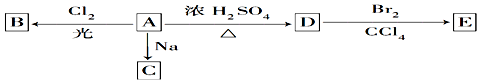
查看答案和解析>>
科目: 来源: 题型:解答题
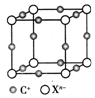 前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com