
科目: 来源: 题型:选择题
| A. | 往碳酸钙溶液中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向次氯酸钙溶液通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| C. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醛、乙醛、丙醛都没有同分异构体 | |
| B. | 已知甲醛是平面型分子,则苯甲醛的所有原子有可能在同一平面上 | |
| C. | 甲醛、乙醛、苯甲醛都能发生加成、氧化和酯化反应 | |
| D. | 可用新制的Cu(OH)2来区分甲醛和苯甲醛 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
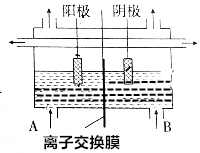 工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.
工业上电解饱和食盐水的方法之一是将两个电极室用离子交换膜隔开(如图所示),其目的是防止H2与Cl2混合发生爆炸,防止Cl2与NaOH反应生成NaClO,使NaOH不纯,阳极室(A处)加入饱和食盐水,阴极室(B极)加入水或稀氢氧化钠溶液,离子交换膜只许Na+离子通过.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
 某研究小组取一定质量的镁铝合金材料投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.请回答下列问题
某研究小组取一定质量的镁铝合金材料投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.请回答下列问题查看答案和解析>>
科目: 来源: 题型:解答题
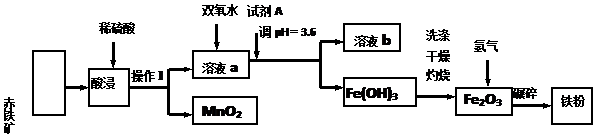
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe (OH)2 | Cu (OH)2 |
| pH | 3.4 | 5.2 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com