
科目: 来源: 题型:选择题
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
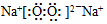 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4>NO2>O2 | B. | O2>SO3>H2SO4 | C. | NO2>O2>SO3 | D. | O2>NO2>SO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用量筒量取16.28mL的浓硫酸 | |
| B. | 用托盘天平准确称取2.00g的NaOH固体 | |
| C. | 常温常压下1molO2的质量为32g | |
| D. | 用250mL的容量瓶配制30%的NaCl溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:
某化学小组设计了铜与浓、稀硝酸反应的一体化实验装置如图所示(部分固定装置省略),实验步骤如下.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,5.6 L CCl4中含有的分子数目为0.25NA | |
| B. | 标准状况下,体积为22.4L的物质所含微粒数是NA | |
| C. | 常温常压下,0.5 mol NH3中含有的原子数目为2NA | |
| D. | 500mL1 mol•L-1 K2SO4溶液中含有的k+数目为2NA |
查看答案和解析>>
科目: 来源: 题型:实验题
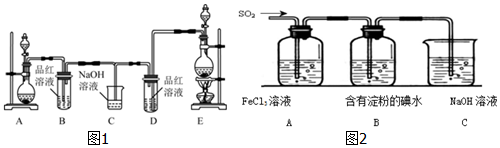
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
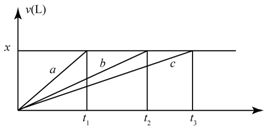 将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com