
科目: 来源: 题型:选择题
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝”是指硝酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
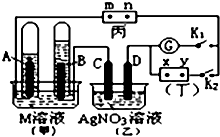 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
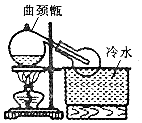 实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.
实验室常用浓H2SO4与NaNO3粉末反应制取HNO3,实验装置如图.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com