
科目: 来源: 题型:解答题
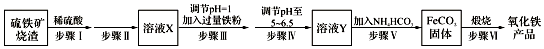
查看答案和解析>>
科目: 来源: 题型:实验题
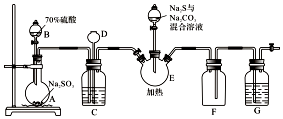 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
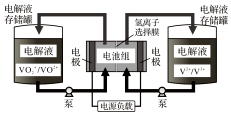 全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )| A. | 放电时,正极电极反应为:VO2++e-+2H+=VO2++H2O | |
| B. | 充电时,阴极电极反应为:V3++e-=V2+ | |
| C. | 放电时,H+从电池右边移向左边 | |
| D. | 利用该电池电解饱和NaCl溶液(石墨作电极),2 mol VO2+发生氧化反应时,可生成气体44.8 L |
查看答案和解析>>
科目: 来源: 题型:选择题
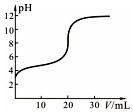 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 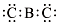 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2- | |
| B. | 1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA | |
| C. | 1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色 | |
| D. | SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
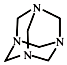
| A. | 化学式为C6H12N4,属于饱和烃 | |
| B. | 不能发生加成反应,一氯取代产物有3种 | |
| C. | 分子中既含极性共价键又含非极性共价键 | |
| D. | 可由甲醛(HCHO)与氨气按物质的量之比3:2完全反应制得 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| B. | 古方记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化 | |
| C. | 绿色化学的核心是减少和消除工业生产对环境的污染 | |
| D. | 通过煤的干馏、气化、液化能获得多种化工原料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置或操作 |  | 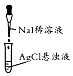 | 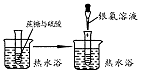 | 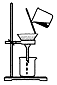 |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com