
科目: 来源: 题型:实验题
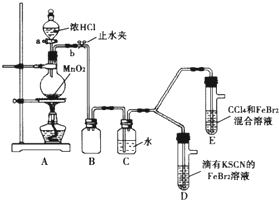 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题: .
.
查看答案和解析>>
科目: 来源: 题型:选择题
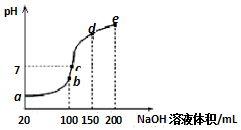 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 溶液的pH:①>②>③ | |
| B. | 整个过程中Fe2(SO4)3溶液可以循环利用 | |
| C. | 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O | |
| D. | 向②溶液中滴加KSCN溶液,溶液可能变为血红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
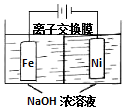 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )| A. | 电解一段时间后,阳极室的c(OH-)增大 | |
| B. | Na+由阴极室移向阳极室 | |
| C. | 阴极反应式:2H2O+2e-=H2↑+2OH- | |
| D. | 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1 Na2CO3溶液的pH约为11;0.1mol•L-1 NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
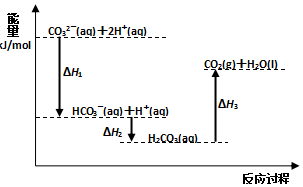
| A. | 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应 | |
| B. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3) | |
| C. | △H1>△H2△H2<△H3 | |
| D. | H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3变小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com