
科目: 来源: 题型:解答题
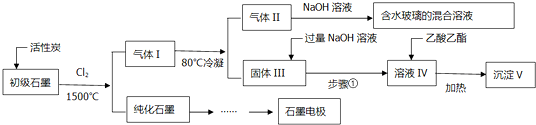
查看答案和解析>>
科目: 来源: 题型:解答题

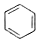 +
+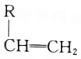 $\stackrel{H_{2}SO_{4}}{→}$
$\stackrel{H_{2}SO_{4}}{→}$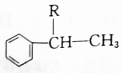 ;
;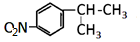 ;A转化为B的反应类型是加成反应.
;A转化为B的反应类型是加成反应. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$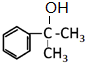 +NaBr.
+NaBr.查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 | |
| B. | 向10mL0.05mol/LKAl(SO4)2溶液中滴加10mL0.1mol/LBa(OH)2溶液,反应后铝元素的主要存在形式是Al3+和Al(OH)3 | |
| C. | AlCl3和NaOH;HCl和NaAlO2;Na2CO3和HCl都可以不用其他试剂能鉴别出来 | |
| D. | 下列四个变化中①④可以通过一步实验直接完成①AlO2-→Al3+②Al2O3→Al(OH)3③Al3+→AlO2-④AlCl3→Al(OH)3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应中还原剂是C,还原产物有两种 | |
| B. | 若有32g硫参加反应,则被硫氧化的碳单质物质的量为3mol | |
| C. | 若在标准状况下生成8.96L气体,则转移的电子数为1.2NA | |
| D. | 产物中的两种气体在一定条件下都能够和Mg发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com