
科目: 来源: 题型:选择题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目: 来源: 题型:解答题
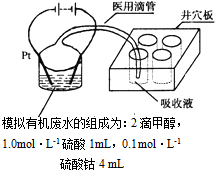 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作及现象 | 实验目的 | |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaCO3)>KSP(BaSO4) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量就是物质的数量 | |
| B. | Mg2+的摩尔质量为24g/mol | |
| C. | 标准状况下,22.4L水的物质的量为1mol | |
| D. | 80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
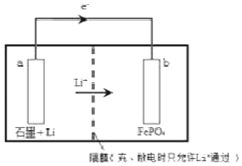 某种锂离子二次电池的总反应为:FePO4(s)+Li(s)?LiFePO4(s),装置如图所示(a极材料为金属锂和石墨的复合材料).下列说法不正确的是( )
某种锂离子二次电池的总反应为:FePO4(s)+Li(s)?LiFePO4(s),装置如图所示(a极材料为金属锂和石墨的复合材料).下列说法不正确的是( )| A. | 图中e-及Li+移动方向说明该电池处于放电状态 | |
| B. | 该电池中a极不能接触水溶液 | |
| C. | 充电时a极连接外接电源的正极 | |
| D. | 充电时,b极电极反应式为:LiFePO4-e-═Li++FePO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c({{N}_{a}}^{+})}{2c(C{{O}_{3}}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba(OH)2溶液中2c(NH4+)=c(Ba2+) | |
| C. | 将CH3COONa溶液从25℃升温至40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 向Mg(OH)2浊液中加入少量NH4Cl粉末,$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
 将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )
将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | a=1.75 | |
| B. | b=0.5 | |
| C. | 原溶液中Al3+与Fe2+的物质的量之比为1:2 | |
| D. | 最后得到的沉淀为Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com