
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
查看答案和解析>>
科目: 来源: 题型:解答题
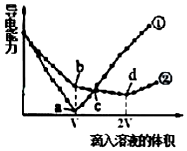 镁、钡是位于同一主族的活泼的金属元素.
镁、钡是位于同一主族的活泼的金属元素. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 起始浓度 (mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | x | 0.05 | 7 |
| A. | HA是弱酸 | |
| B. | x>0.05 | |
| C. | 实验①所得溶液中:c(A-)+c(HA)=0.10mol/L | |
| D. | 实验②所得溶液中:c(Na+)=c(A-) |
查看答案和解析>>
科目: 来源: 题型:选择题
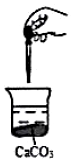 如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )
如图,向烧杯中滴加几滴浓盐酸,CaCO3固体还有剩余(忽略体积、温度的变化),下列数值变小的是( )| A. | c(Ca2+) | B. | c(CO32-) | C. | c(H+) | D. | c(碳酸钙的溶解度) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若3molC12反应,得到氧化产物6mol | |
| B. | 若常温下生成22.4LN2,转移电子数6NA | |
| C. | 若转移6mol电子,被氧化的NH3是8mol | |
| D. | 若生成1 molNH4Cl转移电子n个,则NA=n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com