
科目: 来源: 题型:选择题
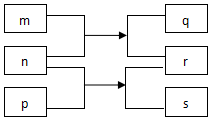 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径大小:Y>Z>W | |
| B. | 简单气态氢化物的稳定性:R>Y | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | 单质熔点:Z>R>X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20 g D2O 含有的质子数为10NA | |
| B. | 1mol Na2O2与足量水反应转移的电子数为NA,生成的气体在标况下的体积为22.4L | |
| C. | 1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目: 来源: 题型:实验题
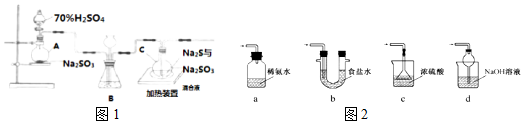
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 28.6g Na2CO3•10H2O晶体中CO32-数目等于0.1NA | |
| B. | 标准状况下,4.48L NO和2.24L O2完全反应后,容器内气体分子数为0.2NA | |
| C. | 0.1mol Na和氧气在一定条件下反应生成3.5g氧化物时,失去的电子数为0.2NA | |
| D. | 含有1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
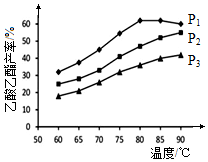 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C4H10与C3H6 | B. | C5H12与C2H6O | C. | C2H2Cl4与CH2Cl2 | D. | CH2O与C2H4O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
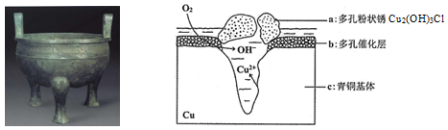
| A. | 青铜器发生电化学腐蚀,图中c作负极,被氧化 | |
| B. | 正极发生的电极反应为O2+4e-+2H2O=4OH- | |
| C. | 环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| D. | 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com